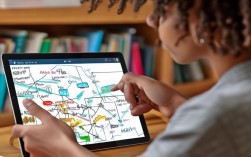
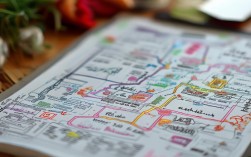
高一化学:钠 元素思维导图
中心主题:钠 (Na)

钠的基本信息
- 元素符号: Na
- 原子序数: 11
- 在元素周期表中的位置:
- 第三周期
- 第 IA 族 (碱金属元素)
- 原子结构示意图:
- (Na) 核电荷数=11,核外电子排布:2, 8, 1
- 最外层电子数:1个 (决定其化学性质活泼)
- 自然界存在形态: 只能以化合态存在 (如 NaCl, Na₂CO₃, NaNO₃),无游离态。
钠的物理性质
- 颜色: 银白色 (新切开的表面)
- 状态: 固体 (质地柔软,可用小刀切割)
- 密度: 0.97 g/cm³ (比水小,但比煤油、汽油大)
- 熔点: 97.8 °C (较低)
- 沸点: 882.9 °C
- 导电性: 良好 (金属的通性)
- 导热性: 良好 (金属的通性)
钠的化学性质 (核心!)
-
与非金属反应 (强还原性)
- 与氧气 (O₂) 反应:
- 常温 (缓慢氧化):
4Na + O₂ = 2Na₂O(白色固体,不稳定) - 加热 (剧烈燃烧):
2Na + O₂ = Na₂O₂(淡黄色固体,过氧化钠)
- 常温 (缓慢氧化):
- 与氯气 (Cl₂) 反应:
2Na + Cl₂ = 2NaCl(剧烈燃烧,产生大量白烟,生成白色固体氯化钠) - 与硫 (S) 反应:
2Na + S = Na₂S(研磨时发生爆炸,生成硫化钠)
- 与氧气 (O₂) 反应:
-
与水反应 (最剧烈的反应之一)
- 现象:
- 浮: 钠块浮在水面上 (ρ_Na < ρ_H₂O)。
- 熔: 熔成闪亮的小球 (反应放热,钠的熔点低)。
- 游: 小球在水面上四处游动 (产生H₂推动)。
- 响: 发出“嘶嘶”的响声 (反应剧烈)。
- 红: 滴入酚酞后,溶液变红 (生成强碱NaOH)。
- 化学方程式:
2Na + 2H₂O = 2NaOH + H₂↑ - 离子方程式:
2Na + 2H₂O = 2Na⁺ + 2OH⁻ + H₂↑
- 现象:
-
与酸反应
- 现象: 比与水反应更剧烈,立即爆炸。
- 化学方程式:
2Na + 2HCl = 2NaCl + H₂↑ - 本质: 酸中的H⁺浓度远大于水,反应速率更快。
-
与盐溶液反应
- 规律: 钠先与水反应,生成的NaOH再与盐溶液可能发生复分解反应。
- 与CuSO₄溶液反应:
2Na + 2H₂O = 2NaOH + H₂↑2NaOH + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄- 总反应:
2Na + 2H₂O + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄ + H₂↑
- 现象: 产生无色气体,生成蓝色沉淀。
钠的制备与保存
-
制备 (工业方法):
- 电解熔融氯化钠 (电解法):
- 原理:
2NaCl(熔融) = 2Na + Cl₂↑ - 设备: 阳极 (石墨)、阴极 (铁)
- 原理:
- 电解熔融氯化钠 (电解法):
-
保存方法:
- 隔绝空气和水。
- 保存介质: 煤油或石蜡油。
- 原因:
- 密度比煤油大,沉在底部。
- 与煤油不反应。
- 隔绝空气中的氧气和水蒸气。
钠的重要化合物
-
氧化钠 (Na₂O)
- 颜色状态: 白色固体
- 化学性质 (碱性氧化物):
Na₂O + H₂O = 2NaOH - 与酸反应:
Na₂O + 2HCl = 2NaCl + H₂O
-
过氧化钠 (Na₂O₂)
- 颜色状态: 淡黄色固体
- 重要化学性质:
- 与水反应 (歧化反应):
2Na₂O₂ + 2H₂O = 4NaOH + O₂↑(产生O₂,是供氧剂) - 与CO₂反应:
2Na₂O₂ + 2CO₂ = 2Na₂CO₃ + O₂↑(用于呼吸面具或潜艇中供氧)
- 与水反应 (歧化反应):
- 特性: 既有氧化性又有还原性 (O₂为-1价,可升至0价,也可降至-2价)。
-
氢氧化钠 (NaOH)
- 俗称: 烧碱、火碱、苛性钠
- 颜色状态: 白色固体 (易潮解)
- 重要化学性质 (强碱):
- 使指示剂变色: 使酚酞变红,使石蕊变蓝。
- 与非金属反应:
2NaOH + Cl₂ = NaCl + NaClO + H₂O(制漂白液) - 与两性氧化物反应:
2NaOH + Al₂O₃ = 2NaAlO₂ + H₂O - 与两性氢氧化物反应:
NaOH + Al(OH)₃ = NaAlO₂ + 2H₂O - 与酸性氧化物反应:
2NaOH + CO₂ = Na₂CO₃ + H₂O(或NaOH + CO₂ = NaHCO₃)
- 用途: 制肥皂、造纸、纺织、炼铝等。
-
碳酸钠 (Na₂CO₃) 与碳酸氢钠 (NaHCO₃)
- 碳酸钠 (纯碱/苏打):
- 颜色状态: 白色粉末
- 溶解性: 易溶于水
- 热稳定性: 稳定,受热不分解 (
Na₂CO₃ --(高温)--> 不分解)
- 碳酸氢钠 (小苏打):
- 颜色状态: 白色晶体
- 溶解性: 溶于水,但比Na₂CO₃小
- 热稳定性: 不稳定,受热分解 (
2NaHCO₃ --(△)--> Na₂CO₃ + H₂O + CO₂↑) (此反应是鉴别它们的重要方法)
- 与酸反应:
Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂↑NaHCO₃ + HCl = NaCl + H₂O + CO₂↑- 现象: 都产生使澄清石灰水变浑浊的气体,但NaHCO₃反应更剧烈。
- 相互转化:
Na₂CO₃ + CO₂ + H₂O = 2NaHCO₃(CO₂通入饱和Na₂CO₃溶液)2NaHCO₃ --(△)--> Na₂CO₃ + H₂O + CO₂↑
- 碳酸钠 (纯碱/苏打):
钠的用途
- 工业制取钠的化合物: NaOH, Na₂CO₃, NaCl等。
- 还原剂: 在某些冶金过程中作还原剂,如制备钛、锆等。
- 合金: 制造钠钾合金 (作原子反应堆的冷却剂)。
- 光源: 高压钠灯 (发出的黄光透雾能力强,用于道路照明)。
安全注意事项
- 取用: 用镊子取用,不能用手直接接触。
- 切割: 在玻璃片上切割,剩余钠块放回原试剂瓶。
- 废料处理: 切下的钠屑或小块钠必须放回煤油中,或用少量乙醇处理 (
2Na + 2CH₃CH₂OH = 2CH₃CH₂ONa + H₂↑),严禁随意丢弃或投入水中。 - 火灾处理: 若钠着火,不能用CO₂灭火器或泡沫灭火器,应用干燥的沙土扑盖。