反应热 思维导图
中心主题:反应热
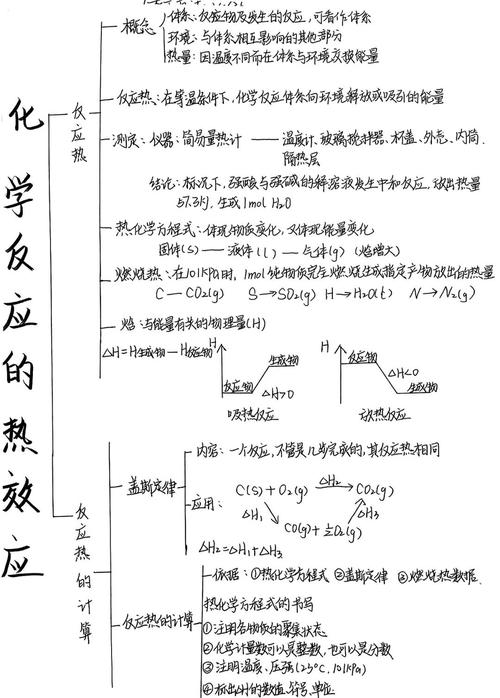
基本概念
-
定义
- 核心:化学反应过程中,当反应物和生成物的温度相同时,所放出或吸收的热量。
- 别称:反应焓变,符号为 ΔH。
- 单位:kJ/mol 或 J/mol (指按反应方程式中的化学计量数进行反应时焓变的值)。
-
特点
- 状态函数:只取决于反应的始态(反应物)和终态(生成物),与反应的具体路径、条件(如是否使用催化剂)、反应速率无关。
- 具有广度性质:ΔH 的数值与物质的量成正比,方程式中的化学计量数加倍,ΔH 也加倍。
-
反应热与键能的关系
- 本质:反应热旧化学键断裂与新化学键形成所吸收和释放能量的差值。
- 计算公式:
ΔH = 反应物总键能 - 生成物总键能 - 解释:
- 吸热反应:断裂旧键吸收的总能量 > 形成新键释放的总能量 (ΔH > 0)。
- 放热反应:断裂旧键吸收的总能量 < 形成新键释放的总能量 (ΔH < 0)。
类型
-
燃烧热
 (图片来源网络,侵删)
(图片来源网络,侵删)- 定义:在 25°C 和 101 kPa 压强下, 1 mol 纯物质 完全燃烧生成稳定的氧化物时所放出的热量。
- 符号:ΔHc (c 代表 combustion)。
- 单位:kJ/mol。
- 要点:
- “完全燃烧”:指物质中的元素完全转化为指定稳定产物。
- C → CO₂(g)
- H → H₂O(l)
- S → SO₂(g)
- N → N₂(g)
- “生成稳定氧化物”:生成物状态必须明确,特别是水必须是液态(H₂O, l)。
- “1 mol 纯物质”:燃烧热的数值是针对1 mol 该物质而言的。
- “完全燃烧”:指物质中的元素完全转化为指定稳定产物。
-
中和热
- 定义:在稀溶液中,强酸和强碱发生中和反应生成 1 mol H₂O(l) 时所放出的热量。
- 符号:ΔHh (h 代表 heat of neutralization)。
- 单位:kJ/mol。
- 要点:
- “稀溶液”:稀溶液中,酸和碱的电离可以看作是完全的,忽略电离热。
- “强酸和强碱”:反应的实质是 H⁺ + OH⁻ = H₂O(l)。
- “生成1 mol H₂O(l)”:中和热的数值是针对生成1 mol 水而言的。
- 标准值:对于强酸强碱的中和反应,ΔHh ≈ -57.3 kJ/mol。
-
溶解热
- 定义:在一定温度和压强下,一定量的物质溶解在溶剂中形成饱和溶液时所放出或吸收的热量。
- 类型:
- 吸热溶解:如 NH₄NO₃(s) → NH₄⁺(aq) + NO₃⁻(aq) (ΔH > 0)。
- 放热溶解:如 NaOH(s) → Na⁺(aq) + OH⁻(aq) (ΔH < 0)。
表示方法
-
热化学方程式
- 定义:表明反应所放出或吸收热量的化学方程式。
- 书写要点:
- 标明状态:必须在各化学式后用括号注明物质的聚集状态,如
g(气)、l(液)、s(固)、aq(水溶液),状态不同,ΔH 不同。 - 标明ΔH:在方程式右边或下方注明 ΔH 的数值和正负号,放热为“-”,吸热为“+”。
- 指明计量数:化学计量数可以是整数,也可以是分数,计量数不同,ΔH 也不同,必须与方程式一一对应。
- 不标注反应条件:与普通方程式不同,热化学方程式不标注“点燃”、“加热”、“催化剂”等,因为这些条件不影响 ΔH。
- 标明状态:必须在各化学式后用括号注明物质的聚集状态,如
- 示例:
H₂(g) + 1/2 O₂(g) = H₂O(l) ΔH = -285.8 kJ/mol(放热)C(s, 石墨) + H₂O(g) = CO(g) + H₂(g) ΔH = +131.3 kJ/mol(吸热)
-
能量变化图
 (图片来源网络,侵删)
(图片来源网络,侵删)- 图示:以反应进程为横坐标,能量为纵坐标的示意图。
- 关键点:
- 反应物总能量:曲线的起点。
- 生成物总能量:曲线的终点。
- 活化能:从反应物总能量达到最高点(活化络合物)所需的能量。
- 反应热 (ΔH):生成物总能量与反应物总能量的差值。
- 放热反应:生成物总能量 < 反应物总能量,ΔH 为负,曲线下降。
- 吸热反应:生成物总能量 > 反应物总能量,ΔH 为正,曲线上升。
计算
-
盖斯定律
- 化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
- 核心思想:可以像代数方程式一样,通过热化学方程式的加减组合来求未知的反应热。
- 计算步骤:
- 写出目标反应的热化学方程式。
- 找出已知的热化学方程式,通过乘以或除以适当的系数,使其反应物和生成物与目标反应一致。
- 将处理后的方程式进行相加或相减,ΔH 也进行相应的运算。
- 消去中间产物,得到目标反应及其 ΔH。
-
利用键能计算
- 公式:
ΔH = 断裂化学键的总键能 - 形成化学键的总键能 - 步骤:
- 写出反应物和生成物的结构式(或电子式),明确所有化学键。
- 查表或题目给出各化学键的键能数据。
- 计算反应物中所有需要断裂的化学键的键能之和。
- 计算生成物中所有新形成的化学键的键能之和。
- 代入公式计算 ΔH。
- 公式:
-
利用燃烧热计算反应热
- 思路:将反应物和生成物都燃烧成稳定的氧化物,利用它们燃烧热的差值来计算反应热。
- 公式:
ΔH = Σ(反应物的燃烧热) - Σ(生成物的燃烧热) - 注意:燃烧热本身是放热,数值为负,计算时要代入带符号的数值。
-
利用中和热计算反应热
- 思路:根据反应中生成水的物质的量来计算。
- 公式:
放出的总热量 = n(H₂O) × |ΔHh| - 应用:常用于测定中和热实验中计算溶液的比热容等。
影响因素
-
内因(决定性因素)
- 物质本身:反应物的结构和性质不同,反应热也不同,完全燃烧1 mol H₂、C、CO放出的热量不同。
-
外因(影响ΔH数值,但改变不大)
- 反应物和生成物的状态:状态不同,能量不同,ΔH 不同。
C(s) + O₂(g) = CO₂(g) ΔH₁C(s) + 1/2 O₂(g) = CO(g) ΔH₂H₂(g) + 1/2 O₂(g) = H₂O(g) ΔH₃H₂(g) + 1/2 O₂(g) = H₂O(l) ΔH₄ΔH₄ < ΔH₃,ΔH₁ ≠ ΔH₂。
- 物质的量:反应物的量不同,反应热的绝对值也不同,但单位物质的量的反应热(ΔH)不变。
- 温度和压强:对于涉及气体的反应,温度和压强的改变会影响 ΔH,但通常我们使用的是 298 K (25°C) 和 101 kPa 下的标准反应热(ΔHθ)。
- 反应物和生成物的状态:状态不同,能量不同,ΔH 不同。
应用
- 热化学方程式的书写与正误判断
- 反应热的计算(综合运用盖斯定律、键能等方法)
- 能源利用
- 燃料的选择:选择燃烧热高、资源丰富、污染小的燃料(如氢能、天然气)。
- 反应热的利用:放热反应用于供暖、发电(如火力发电);吸热反应用于制冷。
- 化工生产
- 选择反应条件:根据反应热,选择合适的温度和压强,以获得最大的产率并节约能源。
- 生物体内能量代谢
食物的消化、ATP的合成与水解等都是生物体内的化学反应,伴随着能量的变化。