化学金属思维导图
中心主题:化学金属
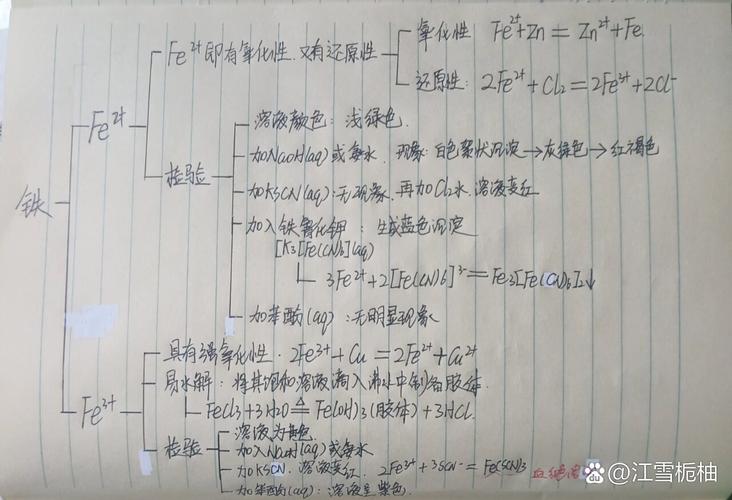
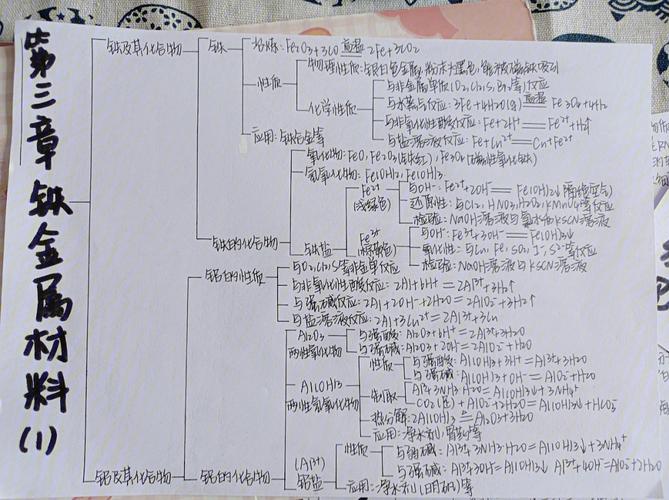
金属的概述
- 定义
- 在元素周期表中,除氢以外的所有元素。
- 具有金属光泽、良好的导电性、导热性和延展性的固体(常温下,汞除外)。
- 原子结构特征
- 最外层电子数较少(通常为1-3个)。
- 容易失去最外层电子,形成阳离子。
- 原子半径较大。
- 物理性质
- 状态: 常温下除汞为液体外,其余均为固体。
- 光泽: 具有独特的金属光泽。
- 导电性: 良好的导体(价电子自由移动)。
- 导热性: 良好的导热体。
- 延展性: 具有良好的延展性(可拉成丝、压成片),如金、铜,但也有脆性金属,如锑、铋。
- 密度与熔沸点: 一般较大,但差异显著(如钠、钾熔点低,钨熔点高)。
- 化学性质共性
- 核心反应: 强还原剂,易失电子被氧化。
- 与氧气反应:
4Na + O₂ = 2Na₂O(常温)2Mg + O₂ = 2MgO(点燃)3Fe + 2O₂ = Fe₃O₄(点燃)2Cu + O₂ = 2CuO(加热)
- 与水反应:
2Na + 2H₂O = 2NaOH + H₂↑(剧烈)Mg + 2H₂O = Mg(OH)₂ + H₂↑(加热)3Fe + 4H₂O(g) = Fe₃O₄ + 4H₂↑(高温)
- 与酸反应:
Zn + H₂SO₄ = ZnSO₄ + H₂↑Fe + 2HCl = FeCl₂ + H₂↑- (排在氢前面的金属)
- 与盐溶液反应:
Fe + CuSO₄ = FeSO₄ + Cu(置换反应,活动性强的置换活动性弱的)
- 与某些非金属反应:
2Fe + 3Cl₂ = 2FeCl₃(生成高价盐)
金属活动性顺序
- 定义: 衡量金属在水溶液中失去电子能力(还原性强弱)的顺序。
- 常见顺序:
- K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
- 钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
- 规律与应用:
- 位置越靠前:
- 金属原子还原性越强。
- 金属阳离子氧化性越弱。
- 与酸或水反应越剧烈。
- 应用:
- 判断置换反应能否发生: 排在前面的金属可以把排在后面的金属从其盐溶液中置换出来(K, Ca, Na除外,会先与水反应)。
- 判断金属与酸反应的剧烈程度: 越靠前,反应越剧烈。
- 判断金属在自然界中的存在形式: K, Ca, Na等活泼金属只以化合态存在;Au, Pt等不活泼金属以游离态存在。
- 位置越靠前:
金属的冶炼
- 实质: 使金属化合物中的金属离子得到电子,被还原成单质的过程。
Mⁿ⁺ + ne⁻ → M
- 方法选择: 根据金属活动性的不同选择不同的方法。
- a. 热分解法: 适用于不活泼金属。
- 原理: 加热其化合物。
- 例子:
2HgO = 2Hg + O₂↑(加热) 2Ag₂O = 4Ag + O₂↑(加热)
- b. 热还原法: 适用于大多数金属(Zn, Fe, Sn, Pb, Cu等)。
- 原理: 使用还原剂(C, CO, H₂, 活泼金属如Al)在高温下将金属还原。
- 例子:
Fe₂O₃ + 3CO = 2Fe + 3CO₂(高炉炼铁)WO₃ + 3H₂ = W + 3H₂O(氢气还原钨)Cr₂O₃ + 2Al = 2Cr + Al₂O₃(铝热法)
- c. 电解法: 适用于非常活泼的金属(K, Ca, Na, Mg, Al)。
- 原理: 通过电解其熔融盐或氧化物,强制氧化还原反应发生。
- 例子:
2NaCl(熔融) = 2Na + Cl₂↑(电解熔融氯化钠制钠)2Al₂O₃(熔融) = 4Al + 3O₂↑(电解氧化铝制铝,冰晶石作助熔剂)
- a. 热分解法: 适用于不活泼金属。
合金
- 定义: 由一种金属与一种或几种其他金属(或非金属)熔合而成的具有金属特性的物质。
- 特点:
- 硬度更大: 如生铁比纯铁硬。
- 熔点更低: 如焊锡(锡铅合金)比纯锡或纯铅熔点低。
- 性能更优: 通常具有更好的强度、耐腐蚀性等。
- 常见合金举例:
- 铁合金:
- 生铁: 含碳量 2%~4.3%,硬而脆。
- 钢: 含碳量 0.03%~2%,坚硬、有韧性、塑性好。
- 铝合金: 硬铝(Al-Cu-Mg-Si),轻而坚固,用于飞机、汽车。
- 铜合金:
- 黄铜: Cu-Zn合金,耐腐蚀。
- 青铜: Cu-Sn合金,耐磨,用于制造轴承、雕塑。
- 钛合金: 高强度、耐高温、耐腐蚀,用于航空航天。
- 铁合金:
金属的腐蚀与防护
- 金属腐蚀
- 定义: 金属或合金与周围环境(O₂, H₂O等)发生化学反应而损耗的过程。
- 本质: 金属被氧化的过程,发生原电池反应。
- 类型:
- 化学腐蚀: 金属与非电解质直接接触(如干燥的O₂, Cl₂)。
- 电化学腐蚀: 在电解质溶液中形成微电池,发生原电池反应,最常见的是 吸氧腐蚀(中性或弱酸性条件下)和 析氢腐蚀(酸性条件下)。
- 金属防护
- a. 改变金属内部结构: 制成不锈钢(加Cr, Ni)。
- b. 形成保护层:
- 电镀: 如镀锌(白铁皮)、镀铬。
- 涂油、刷漆: 如自行车涂漆。
- 形成致密氧化膜: 如铝的“钝化”(Al₂O₃保护层)。
- c. 电化学保护法:
- 牺牲阳极的阴极保护法: 被保护的金属作阴极,连接更活泼的金属作阳极(如轮船的锌块)。
- 外加电流的阴极保护法: 被保护的金属接电源负极作阴极。
- d. 保持干燥、隔绝空气: 如食品包装中放干燥剂。
金属及其化合物的应用
- 单质应用:
- Fe: 钢铁工业,建筑、桥梁、交通工具。
- Al: 导线、电缆、炊具、飞机材料。
- Cu: 导线、电缆、水管。
- Ti: 航空航天、生物医学(人造骨)。
- 化合物应用:
- 氧化物:
CaO(生石灰,作干燥剂、建筑材料),Al₂O₃(耐火材料、电解制铝),Fe₂O₃(铁红颜料、炼铁原料)。 - 碱:
NaOH(烧碱,造纸、肥皂、石油精炼)。 - 盐:
NaCl(食盐),Na₂CO₃(纯碱,玻璃、造纸),CaCO₃(石灰石、建筑材料,补钙剂)。
- 氧化物: