这份导图以“物质构成的奥秘”为核心主线,贯穿了整个初三化学的知识体系,它将帮助你从宏观现象理解微观本质,并掌握化学变化的基本规律。

初三化学全册思维导图 (核心框架)
中心主题:初三化学
- 第一分支:化学基本概念与实验
- 第二分支:物质构成的奥秘
- 第三分支:我们周围的物质 (化学性质与变化)
- 第四分支:化学与社会发展
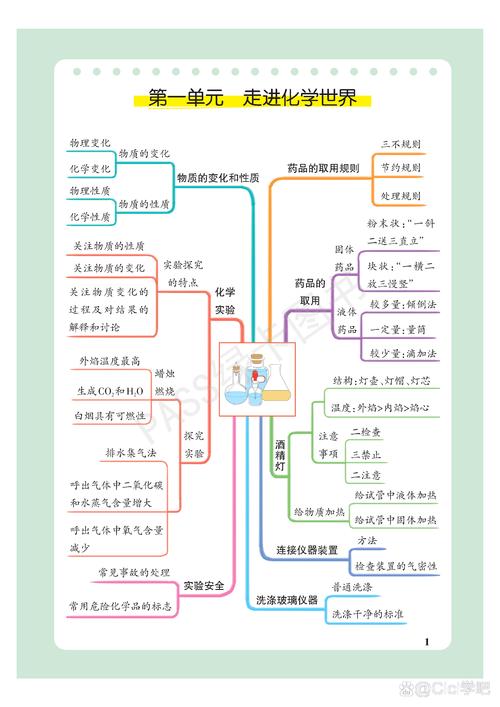
第一分支:化学基本概念与实验
这是化学的“工具箱”和“入门指南”。
-
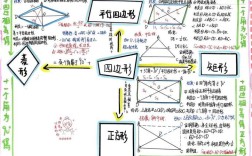
1 物质的分类
- 混合物: 由多种物质组成 (如:空气、溶液、合金)
- 纯净物: 由一种物质组成
- 单质: 由同种元素组成 (如:O₂, Fe, S)
- 化合物: 由不同种元素组成 (如:H₂O, CO₂, KMnO₄)
-
2 物质的性质与变化
 (图片来源网络,侵删)
(图片来源网络,侵删)- 物理性质: 不需要发生化学变化就能体现 (颜色、状态、气味、密度、熔点、沸点、溶解性等)
- 化学性质: 在化学变化中体现 (可燃性、氧化性、酸性、碱性等)
- 物理变化: 没有新物质生成 (如:水蒸发、物质的三态变化)
- 化学变化: 有新物质生成 (如:燃烧、生锈、燃烧)。特征:发光、放热、变色、生成气体、生成沉淀。
- 本质区别: 是否有新物质生成。
-
3 化学用语
- 元素符号: (H, He, C, O, Fe, Cu等) 代表一种元素。
- 化学式: (H₂O, CO₂, NaCl等) 用元素符号和数字表示物质组成的式子。
- 离子符号: (Na⁺, Cl⁻, SO₄²⁻等) 表示带电的原子或原子团。
- 化合价: 元素在形成化合物时表现出的一种性质。应用: 化学式的书写与计算。
- 化学方程式: 用化学式表示化学反应的式子。遵守原则: 质量守恒定律、客观事实。
-
4 化学实验基本操作
- 药品取用: “三不”原则 (不闻、不尝、不摸),固体药品用药匙或镊子;液体用胶头滴管或倾倒。
- 物质加热: 酒精灯“三禁止” (禁止对点、禁止向燃灯添酒精、禁止用嘴吹灭),加热用外焰。
- 仪器连接与气密性检查: “左大右小”连接,手捂法检查。
- 过滤: “一贴、二低、三靠”。(滤纸紧贴漏斗、液面低于滤纸边缘、烧杯紧靠玻璃棒、玻璃棒紧靠三层滤纸、漏斗尖端紧靠烧杯内壁)
- 蒸发: 用玻璃棒不断搅拌,防止局部过热液滴飞溅。
第二分支:物质构成的奥秘
这是化学的“世界观”,从微观角度解释宏观现象。
-
1 构成物质的微粒
 (图片来源网络,侵删)
(图片来源网络,侵删)- 分子: 保持物质化学性质的一种微粒,特征:很小、不断运动、有间隔,物质由分子构成的 (如:H₂O, O₂, CO₂)。
- 原子: 化学变化中的最小微粒,物质由原子直接构成的 (如:Fe, Cu, C)。
- 离子: 带电的原子或原子团,物质由离子构成的 (如:NaCl, CuSO₄)。
- 关系: 分子由原子构成;原子得失电子形成离子。
-
2 原子结构
- 原子核: (质子 + 中子) - 决定原子种类。
- 核外电子: - 决定化学性质。
- 原子序数 = 质子数 (在原子中,质子数 = 核电荷数 = 核外电子数)。
- 相对原子质量 ≈ 质子数 + 中子数。
-
3 元素
- 定义: 质子数 (即核电荷数) 相同的一类原子的总称。
- 与原子的关系: 元素是宏观概念,只讲种类不讲个数;原子是微观概念,既讲种类又讲个数。
- 元素符号: 表示一种元素。
- 元素周期表: 按原子序数排列。
-
4 物质组成的表示
- 化学式的意义:
- 宏观:表示一种物质;表示该物质由哪些元素组成。
- 微观:表示该物质的一个分子;表示一个分子由哪些原子构成。
- 化合价与化学式: 根据化合价规则书写和判断化学式。
- 有关化学式的计算:
- 相对分子质量 = 各原子相对原子质量 × 原子个数之和。
- 各元素质量比 = 各元素的相对原子质量 × 原子个数之比。
- 某元素的质量分数 = (该元素的相对原子质量 × 原子个数 / 相对分子质量) × 100%。
- 化学式的意义:
-
5 质量守恒定律
- 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
- 微观解释: 化学反应前后,原子的种类、数目、质量均不改变。
- “五个不变”: 原子种类、原子数目、原子质量、元素种类、物质总质量。
- “两个一定改变”: 物质的种类、分子的种类。
- “一个可能改变”: 分子总数。
第三分支:我们周围的物质 (化学性质与变化)
这是化学的“应用篇”,将理论与具体物质和反应结合。
-
1 空气
- 成分: 氮气 (N₂, 78%)、氧气 (O₂, 21%)、稀有气体、二氧化碳等。
- 氧气 (O₂):
- 物理性质: 无色无味气体,不易溶于水,密度比空气略大。
- 化学性质: 支持燃烧,供给呼吸 (具有氧化性)。
- 化学方程式:
- C + O₂ ---(点燃)--> CO₂ (发出白光)
- S + O₂ ---(点燃)--> SO₂ (明蓝紫色火焰)
- 4P + 5O₂ ---(点燃)--> 2P₂O₅ (大量白烟)
- 3Fe + 2O₂ ---(点燃)--> Fe₃O₄ (火星四射)
- 二氧化碳 (CO₂):
- 物理性质: 无色无味气体,密度比空气大,能溶于水,固体叫“干冰”。
- 化学性质: 不支持燃烧,不能燃烧;与水反应生成碳酸 (H₂CO₃);与石灰水反应。
- 化学方程式:
- CO₂ + H₂O → H₂CO₃
- CO₂ + Ca(OH)₂ → CaCO₃↓ + H₂O (检验CO₂)
- 空气污染: SO₂, NO₂, CO, 可吸入颗粒物等。
-
2 水与溶液
- 水的组成: 电解水 2H₂O ---(通电)--> 2H₂↑ + O₂↑ (V(H₂):V(O₂) = 2:1),证明水由氢、氧元素组成。
- 硬水与软水: 含较多可溶性钙、镁化合物的水是硬水。
- 鉴别: 用肥皂水,泡沫少浮渣多的是硬水。
- 软化方法: 煮沸、蒸馏。
- 溶液:
- 特征: 均一、稳定。
- 组成: 溶质 (被溶解的物质) + 溶剂 (能溶解其他物质的物质)。
- 溶解度: 在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
- 溶解度曲线: 表示溶解度随温度变化的曲线。
- 乳化: 洗洁精等使油污分散成细小液滴,随水冲走。
-
3 碳和碳的氧化物
- 碳的单质:
- 金刚石: 硬度最大。
- 石墨: 质软、有滑感、能导电。
- C₆₀: 足球烯。
- 化学性质: 常温下稳定;高温下具有可燃性和还原性。
- C + O₂ ---(点燃)--> CO₂ (充分燃烧)
- 2C + O₂ ---(点燃)--> 2CO (不充分燃烧)
- C + 2CuO ---(高温)--> 2Cu + CO₂↑ (还原性)
- 一氧化碳:
- 物理性质: 无色无味气体,有毒 (与血红蛋白结合),难溶于水。
- 化学性质: 可燃性 2CO + O₂ ---(点燃)--> 2CO₂;还原性 3CO + Fe₂O₃ ---(高温)--> 2Fe + 3CO₂。
- 二氧化碳: 见3.1。
- 碳的单质:
-
4 金属与金属材料
- 金属的物理性质: 有光泽、导电性、导热性、延展性等。
- 金属活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
- 应用:
- 判断金属与酸能否反应 (H前的金属)。
- 判断金属与盐溶液能否反应 (前置后,盐可溶)。
- 判断金属活动性强弱。
- 应用:
- 金属的化学性质:
- 与氧气反应 (如:3Fe + 2O₂ ---(点燃)--> Fe₃O₄)。
- 与酸反应 (如:Fe + 2HCl → FeCl₂ + H₂↑)。
- 与盐溶液反应 (如:Fe + CuSO₄ → FeSO₄ + Cu)。
- 金属的腐蚀与防护:
- 铁生锈: 铁与氧气、水共同作用的结果。
- 防锈: 保持干燥、隔绝氧气 (如:刷漆、涂油、镀金属、制成不锈钢)。
-
5 酸和碱
- 常见的酸:
- 盐酸: HCl
- 硫酸: H₂SO₄
- 酸的通性:
- 使紫色石蕊试液变红,无色酚酞不变色。
- 与活泼金属反应生成盐和氢气。
- 与金属氧化物反应生成盐和水 (除锈)。
- 与某些盐反应生成新酸和新盐。
- 与碱发生中和反应。
- 常见的碱:
- 氢氧化钠: NaOH (俗称烧碱、火碱、苛性钠),易潮解,有强腐蚀性。
- 氢氧化钙: Ca(OH)₂ (俗称熟石灰、消石灰),微溶于水。
- 碱的通性:
- 使紫色石蕊试液变蓝,无色酚酞变红。
- 与非金属氧化物反应生成盐和水。
- 与酸发生中和反应。
- 与某些盐反应生成新碱和新盐。
- 中和反应: 酸与碱作用生成盐和水的反应,应用:治疗胃酸、改良酸性土壤等。
- 常见的酸:
-
6 盐和化肥
- 常见的盐:
- 氯化钠: NaCl (食盐)
- 碳酸钠: Na₂CO₃ (俗称纯碱、苏打,水溶液呈碱性)
- 碳酸氢钠: NaHCO₃ (俗称小苏打)
- 粗盐提纯: 溶解、过滤、蒸发。
- 复分解反应: 由两种化合物互相交换成分,生成另外两种化合物的反应。发生条件: 生成沉淀、气体或水。
- 化肥: 氮肥 (促进茎叶生长)、磷肥 (促进根系发育)、钾肥 (抗倒伏、抗病虫害)、复合肥。
- 常见的盐:
第四分支:化学与社会发展
将化学知识与现实生活、社会热点联系起来。
-
1 燃料与燃烧
- 燃烧的条件: ① 可燃物;② 氧气 (或空气);③ 达到着火点 (三者缺一不可)。
- 灭火的原理: ① 清除可燃物;② 隔绝氧气 (或空气);③ 使温度降到着火点以下。
- 化石燃料: 煤、石油、天然气 (都是混合物)。
- 能源与环保: 使用清洁能源 (氢能、太阳能、风能),减少污染。
-
2 化学与材料
- 金属材料: 合金 (性能优于纯金属)。
- 无机非金属材料: 水泥、玻璃、陶瓷。
- 有机合成材料: 塑料、合成纤维、合成橡胶 (三大合成材料)。
- “白色污染”: 塑料垃圾造成的污染。解决方法: 减少使用、重复使用、使用可降解塑料、回收利用。
-
3 化学与健康
- 人体中的元素: 常量元素 (O, C, H, N, Ca, P等)、微量元素 (Fe, Zn, I, Se等)。
- 均衡营养: 六大营养素 (水、无机盐、糖类、油脂、蛋白质、维生素)。
- 有害物质: 甲醛、黄曲霉素、一氧化碳、亚硝酸盐等。
-
4 化学与环境保护
- 空气污染: 工业废气、汽车尾气、酸雨等。
- 水污染: 工业废水、生活污水、农业污染等。
- 治理措施: 工业废气处理、污水处理、植树造林、开发新能源。
如何使用这份思维导图
- 打印出来: 把它打印成一张大图,贴在书桌前或墙上,时常观看。
- 动手绘制: 不要只是看,最好自己拿张纸,以这个框架为参考,亲手画一遍,在绘制过程中,你会加深对知识点的理解和记忆。
- 填充细节: 在每个小分支下,用不同颜色的笔写下具体的化学方程式、实验现象、重要数据等。
- 复习与回顾: 每次复习时,看着导图,尝试回忆每个分支下的具体内容,检查自己的知识盲区。
- 专题突破: 针对薄弱环节,化学方程式计算”或“酸碱盐”,可以单独画出更详细的子导图。
希望这份思维导图能帮助你构建清晰的知识体系,在化学学习上取得优异成绩!