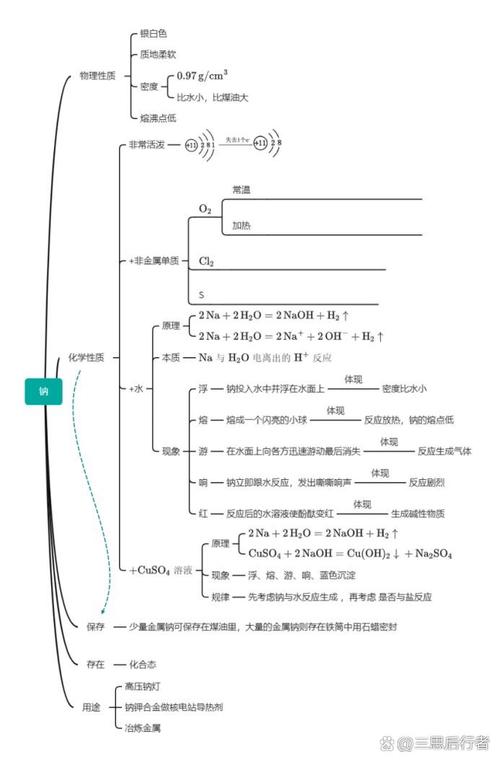
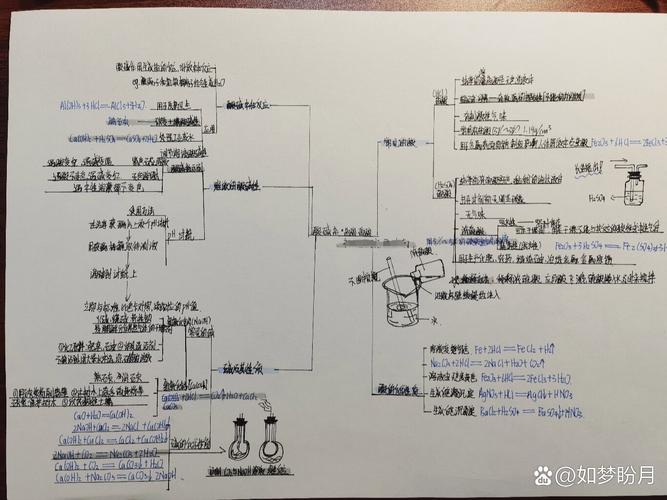
碱作为化学中重要的基础物质,其性质、分类、应用及相关化学反应构成了化学学习的核心内容之一,以下从多个维度对碱的知识体系进行梳理,通过思维导图的形式呈现关键节点,并辅以表格对比,帮助系统理解。
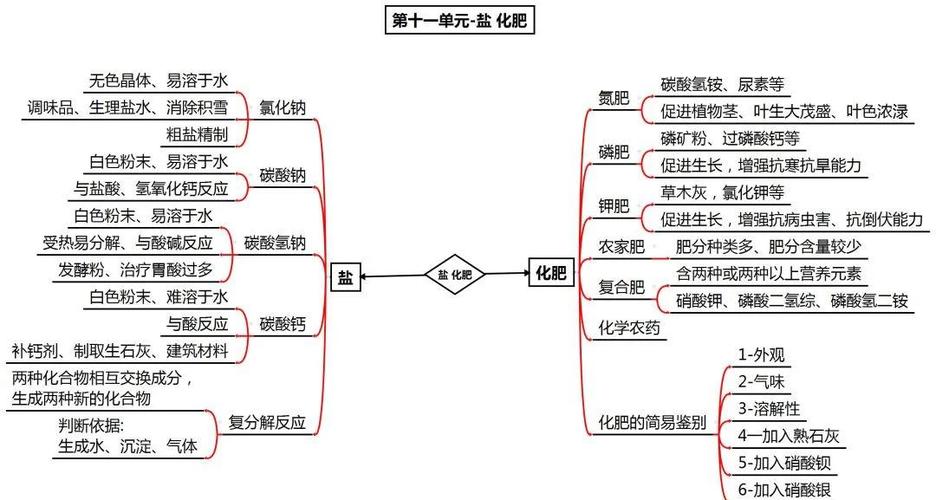
碱的定义源于电离理论,通常指在水溶液中电离出的阴离子全部是氢氧根离子(OH⁻)的化合物,如氢氧化钠(NaOH)、氢氧化钙[Ca(OH)₂]等,根据溶解性,碱可分为可溶性碱(如KOH、NaOH、Ba(OH)₂)和难溶性碱(如Fe(OH)₃、Cu(OH)₂);根据碱性强弱,则分为强碱(如NaOH完全电离)和弱碱(如NH₃·H₂O部分电离),碱的化学性质主要体现在与酸、盐、非金属氧化物及指示剂的反应:碱与酸发生中和反应生成盐和水,与某些盐溶液反应生成沉淀(如FeCl₃与NaOH反应生成红褐色Fe(OH)₃沉淀),与CO₂等非金属氧化物反应生成盐和水(如NaOH与CO₂反应生成Na₂CO₃和H₂O),碱溶液能使紫色石蕊试液变蓝,无色酚酞试液变红,这一特性常用于酸碱性的检验。
碱的制备方法多样,工业上常用苛化法(纯碱与石灰水反应)制备NaOH,电解法电解饱和食盐水也可得到NaOH和H₂;实验室中则可通过碱性氧化物与水反应(如CaO+H₂O→Ca(OH)₂)或复分解反应(如Ca(OH)₂与Na₂CO₃反应制备NaOH)制取,碱的应用广泛,其中氢氧化钠是重要的化工原料,用于造纸、肥皂、纺织等工业;氢氧化钙常用于改良酸性土壤、配制农药波尔多液;氢氧化铝则作为胃药中和过多胃酸,需要注意的是,碱具有腐蚀性(如浓NaOH能腐蚀皮肤和织物),使用时需注意安全,且多数碱(除NaOH、KOH外)受热易分解(如Cu(OH)₂→CuO+H₂O)。
以下是碱的常见分类及性质对比表:
| 分类依据 | 类型 | 代表物质 | 溶解性 | 碱性强弱 | 热稳定性 |
|---|---|---|---|---|---|
| 溶解性 | 可溶性碱 | NaOH、KOH、Ba(OH)₂ | 易溶于水 | 强碱 | 稳定,受热不分解 |
| 难溶性碱 | Fe(OH)₃、Cu(OH)₂、Mg(OH)₂ | 难溶于水或微溶 | 弱碱或两性 | 受热易分解,生成氧化物和水 | |
| 碱性来源 | 氢氧化物 | NaOH、Ca(OH)₂ | |||
| 氨水(弱碱) | NH₃·H₂O | 易溶于水 | 弱碱 | 不稳定,易分解挥发 | |
| 特殊性质 | 两性氢氧化物 | Al(OH)₃、Zn(OH)₂ | 难溶于水 | 两性 | 受热分解为氧化物和水 |
碱的化学性质总结如下:
- 与酸的中和反应:碱+酸→盐+水,如2NaOH+H₂SO₄→Na₂SO₄+2H₂O。
- 与盐的反应:碱+盐→新碱+新盐,条件之一是生成沉淀或气体,如2NaOH+CuSO₄→Cu(OH)₂↓+Na₂SO₄。
- 与非金属氧化物反应:碱+非金属氧化物→盐+水,如2NaOH+CO₂→Na₂CO₃+H₂O(CO₂过量时生成NaHCO₃)。
- 与指示剂反应:使紫色石蕊变蓝,无色酚酞变红(碱溶液需可溶)。
- 热分解反应:难溶性碱受热分解,如Cu(OH)₂(Δ)→CuO+H₂O。
碱的用途与其性质密切相关:NaOH的强碱性和腐蚀性使其可用于油脂皂化反应(制造肥皂);Ca(OH)₂的碱性温和且成本低,适合农业改良酸性土壤;Al(OH)₃的两性使其既能与酸反应又能与强碱反应,用作抗酸药(如胃舒平)和阻燃剂,碱在环境保护中也发挥重要作用,如工业废气中的SO₂可用NaOH溶液吸收(2NaOH+SO₂→Na₂SO₃+H₂O),减少酸雨形成。
在碱的学习中,需注意常见误区:一是并非所有含OH⁻的化合物都是碱(如CH₃CH₂OH含OH⁻但呈中性),二是难溶性碱并非没有碱性,只是因其溶解度低,反应速率较慢,碱的保存需密封干燥,防止与空气中的CO₂反应变质(如NaOH暴露在空气中会生成Na₂CO₃)。
相关问答FAQs
Q1:如何区分氢氧化钠和氢氧化钙两种碱?
A:可通过溶解性、与CO₂的反应及溶液碱性强度区分,氢氧化钠易溶于水,氢氧化钙微溶于水(石灰水);向两种碱溶液中通入过量CO₂,NaOH反应生成Na₂CO₃(无明显现象,若继续通CO₂生成NaHCO₃沉淀),而Ca(OH)₂反应生成CaCO₃白色沉淀;NaOH溶液碱性比Ca(OH)₂溶液更强(等浓度下pH更高)。
Q2:为什么氢氧化铝既能治疗胃酸过多,又能治疗胃溃疡?
A:氢氧化铝是两性氢氧化物,既能与胃酸中的盐酸反应(Al(OH)₃+3HCl→AlCl₃+3H₂O),中和过多胃酸,缓解胃酸过多症状;其反应产物氯化铝和水无刺激性,且Al(OH)₃胶体可在溃疡表面形成保护膜,隔绝胃酸对溃疡面的刺激,促进愈合,因此兼具抗酸和保护作用。