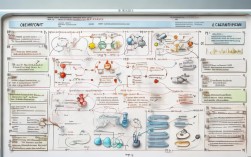
之一,它用简洁的符号和数字表示化学反应中的反应物、生成物以及各物质之间的定量关系,为了系统地理解和掌握化学方程式的相关知识,可以通过思维导图的方式进行梳理,将零散的知识点串联成网络,形成清晰的知识框架,以下从化学方程式的定义、书写原则、配平方法、分类应用及常见误区等方面展开详细说明,并辅以表格归纳关键内容,最后通过FAQs解答常见疑问。

化学方程式的定义是理解其作用的基础,从宏观角度看,化学方程式是描述化学反应的“语言”,它反映了哪些物质参加了反应,生成了哪些新物质,以及反应条件(如加热、催化剂等)和状态变化(如气体生成、沉淀产生等),从微观角度看,化学方程式遵循质量守恒定律,即反应前后原子的种类、数目和质量均保持不变,氢气燃烧生成水的化学方程式为2H₂ + O₂ = 2H₂O,该式表明2个氢分子与1个氧分子在点燃条件下反应生成2个水分子,反应前后氢、氧原子的数目均为4个和2个,符合质量守恒。
书写化学方程式需要遵循一定的原则和步骤,必须以客观事实为基础,不能随意臆造不存在的反应或物质,要遵守质量守恒定律,通过配平使反应前后各原子的数目相等,书写步骤通常包括:①根据反应事实写出反应物和生成物的化学式,中间用“→”连接;②标注反应条件(如“点燃”“加热”“催化剂”等)和生成物的状态(气体用“↑”标注,沉淀用“↓”标注);③配平化学方程式,确保左右两边各原子数目相等;④将“→”改为“=”(表示可逆反应时用“⇌”),实验室制取氧气的反应中,高锰酸钾受热分解的化学方程式书写步骤为:2KMnO₄ $\xrightarrow{\Delta}$ K₂MnO₄ + MnO₂ + O₂↑,Δ”表示加热,“↑”表示氧气为气体状态。
配平化学方程式是学习中的重点和难点,常用的配平方法包括观察法、最小公倍数法、奇数配偶法、得失电子法(氧化还原反应)等,观察法适用于简单的化学反应,如H₂ + Cl₂ = 2HCl,直接观察左右两边原子数目即可配平,最小公倍数法适用于某种原子在左右两边数目差异较大的情况,例如KClO₃ → KCl + O₂,氧原子左边3个、右边2个,最小公倍数为6,在KClO₃前乘2,O₂前乘3,再调整KCl的化学式前系数为2,得到2KClO₃ $\xrightarrow{\Delta}$ 2KCl + 3O₂↑,奇数配偶法适用于反应物中某种原子数目为奇数的情况,如C₂H₅OH + O₂ → CO₂ + H₂O,氢原子左边6个、右边2个,先将H₂O前系数定为3,再调整其他系数,氧化还原反应的配平则需要根据化合价升降总数相等的原则,如CuO + H $\xrightarrow{\Delta}$ Cu + H₂O,氢元素化合价从0升至+1,氧元素从-2降至-2,通过得失电子相等配平。
化学方程式可以根据反应类型进行分类,常见的分类方式包括化合反应、分解反应、置换反应、复分解反应及氧化还原反应等,化合反应是由两种或两种以上物质生成一种物质的反应,如CaO + H₂O = Ca(OH)₂;分解反应是由一种物质生成两种或两种以上物质的反应,如2H₂O $\xrightarrow{\text{通电}}$ 2H₂↑ + O₂↑;置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,如Fe + CuSO₄ = FeSO₄ + Cu;复分解反应是两种化合物相互交换成分生成另外两种化合物的反应,如NaCl + AgNO₃ = AgCl↓ + NaNO₃;氧化还原反应则是涉及化合价变化的反应,如2Mg + O₂ $\xrightarrow{\text{点燃}}$ 2MgO,下表总结了常见反应类型的特点及实例:
| 反应类型 | 特点 | 实例 |
|---|---|---|
| 化合反应 | 多变一 | 3Fe + 2O₂ $\xrightarrow{\text{点燃}}$ Fe₃O₄ |
| 分解反应 | 一变多 | 2HgO $\xrightarrow{\Delta}$ 2Hg + O₂↑ |
| 置换反应 | 单质+化合物→新单质+新化合物 | Zn + H₂SO₄ = ZnSO₄ + H₂↑ |
| 复分解反应 | 化合物+化合物→新化合物+新化合物 | HCl + NaOH = NaCl + H₂O |
| 氧化还原反应 | 化合价变化(电子转移) | C + 2CuO $\xrightarrow{\text{高温}}$ 2Cu + CO₂↑ |
化学方程式的应用广泛,涉及化学计算的多个领域,根据化学方程式可以进行质量计算、气体体积计算、产率计算等,计算的核心步骤包括:①正确书写并配平化学方程式;②找出已知量和未知量;③根据“质量比=相对分子质量×化学计量数之比”列比例式求解,计算65g锌与足量稀硫酸反应生成氢气的质量,步骤为:①Zn + H₂SO₄ = ZnSO₄ + H₂↑;②已知Zn的质量为65g,设生成H₂的质量为x;③列比例式:$\frac{65}{65} = \frac{2}{x}$,解得x=2g,化学方程式还可用于解释化学现象,如铁生锈的原理(4Fe + 3O₂ + 6H₂O = 4Fe(OH)₃),指导化工生产(如合成氨反应N₂ + 3H₂ $\xrightarrow{\text{高温高压、催化剂}}$ 2NH₃)等。
在学习化学方程式时,常见误区包括:①忽略反应条件,如未标注“点燃”“加热”等导致方程式不完整;②化学式书写错误,如将“氧化镁”写成“MgO₂”;③配平时更改化学式中的下标,如将H₂O的系数调整为2时,错误地写成H₂O₂;④忽略气体沉淀符号,如生成CO₂未标注“↑”;⑤对复分解反应的发生条件理解不清,如生成物中若无沉淀、气体或水,反应则不能发生,为避免这些误区,需强化基础知识的记忆,通过练习巩固书写规范,并注重对反应原理的理解。
相关问答FAQs:
Q1:如何快速判断一个化学方程式是否已经配平?
A1:判断化学方程式是否配平的方法主要有三种:①原子个数法:逐一检查反应前后各原子的数目是否相等,这是最基本的方法;②观察法:通过观察左右两边相同原子的总数是否一致,适用于简单方程式;③奇偶法:检查左右两边出现次数较少的原子是否奇偶数一致,若不一致则未配平,对于方程式CH₄ + O₂ → CO₂ + H₂O,左边C原子1个、H原子4个、O原子2个,右边C原子1个、H原子2个、O原子3个,显然未配平,需调整系数为CH₄ + 2O₂ → CO₂ + 2H₂O,此时左右各原子数目均为C:1、H:4、O:4,配平完成。
Q2:在书写化学方程式时,什么情况下需要标注“↑”或“↓”?
A2:“↑”和“↓”是生成物的状态符号,标注需满足以下条件:①“↑”用于生成物中是气体的情况,若反应物中已有气体,则生成物中的气体无需标注“↑”,如C + O₂ $\xrightarrow{\text{点燃}}$ CO₂中,反应物和生成物均有气体,故CO₂无需标注“↑”;②“↓”用于生成物中是沉淀的情况,如CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄中,Cu(OH)₂是沉淀,需标注“↓”;③若反应在溶液中进行,生成物中即使有气体或沉淀,也需标注,如CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑,CO₂是气体,需标注“↑”,需要注意的是,“↑”和“↓”只能标注在生成物化学式的右边,不能标注在反应物或化学式内部。