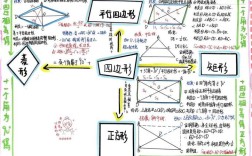
,涵盖了物质结构、元素周期律、化学反应与能量、有机化学等重要知识点,通过思维导图的方式梳理这些内容,可以帮助学生建立系统的知识框架,加深对化学概念的理解和记忆,以下从核心模块出发,详细展开必修二化学的知识体系。
在物质结构基础部分,原子结构是核心内容,原子由原子核和核外电子构成,原子核由质子和中子组成,其中质子数决定元素的种类,中子数影响原子的相对原子质量,核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则,分电子层(K、L、M层等)和亚层(s、p、d轨道)填充,碳原子(6号元素)的电子排布式为1s²2s²2p²,最外层有4个电子,易形成共价键,元素周期表则是原子结构的周期性变化的体现,周期(横行)对应电子层数,族(纵列)对应最外层电子数,主族元素的化合价与最外层电子数密切相关,如第ⅠA族元素+1价,第ⅦA族元素-1价,元素性质(原子半径、金属性、非金属性)随原子序数递增呈周期性变化,同周期从左到右非金属性增强,同主族从上到下金属性增强。
化学键与分子结构是理解物质性质的关键,离子键是活泼金属与活泼非金属通过电子得失形成,如NaCl中Na⁺与Cl⁻通过静电作用结合;共价键是非金属原子通过共用电子对形成,分为极性共价键(如HCl中电子对偏向Cl)和非极性共价键(如Cl₂中电子对均摊),分子空间结构取决于中心原子的价层电子对互斥模型,如CH₄呈正四面体(4对成键电子),H₂O呈V形(2对成键电子、2对孤电子对对),分子间作用力包括范德华力和氢键,氢键使H₂O、HF等物质的沸点异常升高,影响物质的溶解性(如NH₃极易溶于水)。
化学反应与能量模块中,化学反应伴随能量变化,本质是旧化学键断裂吸热与新化学键形成放热的差值,放热反应(如燃烧、中和反应)ΔH<0,吸热反应(如大多数分解反应)ΔH>0,热化学方程式需注明物质状态、ΔH及反应条件,如2H₂(g)+O₂(g)=2H₂O(l) ΔH=-571.6 kJ/mol,原电池是将化学能转化为电能的装置,负极发生氧化反应(如Zn-2e⁻=Zn²⁺),正极发生还原反应(如Cu²⁺+2e⁻=Cu),构成闭合回路形成电流,常见电池有锌锰电池、锂电池等;电解池则是在外接电源下强制发生氧化还原反应,阳极接电源正极(失电子),阴极接电源负极(得电子),如电解饱和食盐水生成NaOH、H₂和Cl₂。
有机化学基础以碳化合物为核心,烃类包括烷烃(CₙH₂ₙ₊₂,如甲烷CH₄,性质稳定)、烯烃(含C=C,如乙烯C₂H₄,能发生加成反应)、炔烃(含C≡C,如乙炔C₂H₂)和芳香烃(如苯C₆H₆,易取代难加成),烃的衍生物通过官能团分类:羟基(-OH)形成醇类(如乙醇CH₃CH₂OH,能与Na反应生成H₂),羧基(-COOH)形成羧酸(如乙酸CH₃COOH,显酸性),酯基(-COO-)形成酯类(如乙酸乙酯CH₃COOCH₂CH₃,水解生成酸和醇),有机反应类型包括取代反应(如烷烃卤代、苯的硝化)、加成反应(如乙烯与Br₂反应)、消去反应(如乙醇脱水生成乙烯)和聚合反应(如乙烯加聚为聚乙烯)。
化学与可持续发展部分,关注资源利用与环境保护,金属冶炼中,活泼金属(如Al、Na)用电解法,不活泼金属(如Hg、Ag)用热分解法,中等活泼金属(如Fe、Zn)用热还原法(如CO还原Fe₂O₃),海水资源的开发包括海水淡化(蒸馏、电渗析法)、提取Br₂(通Cl₂氧化、萃取)和Mg(Ca(OH)₂沉淀、电解MgCl₂),环境保护方面,减少化石燃料使用开发新能源(太阳能、氢能),治理工业废气(SO₂用氨水吸收)、废水(重金属离子沉淀法)和白色污染(可降解塑料)。
以下是相关问答FAQs:
Q1:如何通过元素周期表判断原子半径大小?
A:原子半径取决于电子层数和核电荷数,电子层数越多,半径越大(如Na>Mg>Al);同周期元素,核电荷数越大,半径越小(如Na>Mg>Al);同主族元素,电子层数越多,半径越大(如Li<Na<K),阳离子半径小于对应原子(如Na⁺<Na),阴离子半径大于对应原子(如Cl⁻>Cl)。
Q2:原电池和电解池的本质区别是什么?
A:原电池是自发进行的氧化还原反应,将化学能转化为电能(如铜锌原电池);电解池是在外接电源作用下强制发生的氧化还原反应,将电能转化为化学能(如电解CuCl₂溶液),两者电极名称与反应类型相反:原电池负极失电子发生氧化反应,电解池阳极失电子发生氧化反应;原电池正极得电子发生还原反应,电解池阴极得电子发生还原反应。