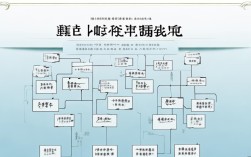
离子反应 思维导图
中心主题:离子反应
基础概念
- 电解质与非电解质
- 定义:在水溶液中或熔融状态下能导电的化合物。
- 类别:
- 强电解质:在水溶液中完全电离。
- 强酸:HCl, H₂SO₄, HNO₃, HClO₄等
- 强碱:NaOH, KOH, Ca(OH)₂, Ba(OH)₂等
- 大多数盐:NaCl, KNO₃, CuSO₄等
- 弱电解质:在水溶液中部分电离。
- 弱酸:CH₃COOH, H₂CO₃, HClO等
- 弱碱:NH₃·H₂O, Cu(OH)₂, Fe(OH)₃等
- 强电解质:在水溶液中完全电离。
- 非电解质:在水溶液中和熔融状态下都不能导电的化合物。
- 举例:非金属氧化物(SO₂, CO₂, SO₃)、非酸性气体(CO, N₂)、部分有机物(蔗糖、酒精)。
- 电离
- 定义:电解质在水分子的作用下或受热熔化时,离解成自由移动的离子的过程。
- 电离方程式:
- 表示方法:用化学式和离子符号来表示电离过程的式子。
- 书写规则:
- 强电解质用“=”,弱电解质用“⇌”。
- 原子个数、电荷总数均守恒。
- 举例:
- NaCl = Na⁺ + Cl⁻
- CH₃COOH ⇌ CH₃COO⁻ + H⁺
- 离子反应
- 定义:有离子参加或有离子生成的反应。
- 本质:溶液中离子浓度的减小。
离子反应的类型
- 复分解反应
- 定义:两种化合物互相交换成分,生成另外两种化合物的反应。
- 发生条件:生成沉淀、气体或弱电解质(水)。
- 核心:离子共存问题。
- 氧化还原反应
- 定义:有电子转移(化合价升降)的离子反应。
- 特征:有元素化合价的变化。
- 举例:
- 置换反应:Fe + Cu²⁺ = Fe²⁺ + Cu
- 部分化合反应:2Fe²⁺ + Cl₂ = 2Fe³⁺ + 2Cl⁻
- 部分分解反应:2H⁺ + 2I⁻ + H₂O₂ = I₂ + 2H₂O
- 络合反应
- 定义:简单离子与配位体结合,形成更稳定的复杂离子(络离子)的反应。
- 举例:Ag⁺ + 2NH₃·H₂O = [Ag(NH₃)₂]⁺ + 2H₂O (此反应可用于检验Ag⁺)
离子方程式
- 定义:用实际参加反应的离子符号来表示离子反应的式子。
- 书写步骤(“写、拆、删、查”)
- 写:写出反应的化学方程式。
- 拆:将易溶于水、易电离的物质(强酸、强碱、可溶性盐)拆写成离子形式。难溶物、难电离物(弱电解质)、气体、单质、氧化物、非电解质等不拆。
- 删:删去方程式两边不参与反应的离子(即“旁观离子”)。
- 查:
- 原子守恒:检查左右两边各原子个数是否相等。
- 电荷守恒:检查左右两边离子所带电荷总数是否相等。
- 意义
- 表示一类反应:揭示了化学反应的实质。
- 举例:H⁺ + OH⁻ = H₂O 可表示所有强酸和强碱的中和反应。
- 简化化学方程式。
- 表示一类反应:揭示了化学反应的实质。
离子共存
- 定义:离子之间若不发生化学反应,就能在溶液中大量共存。
- 不能共存的情况(即能发生离子反应的情况)
- 生成沉淀:
- SO₄²⁻ 与 Ba²⁺, Ca²⁺, Pb²⁺, Ag⁺
- Cl⁻ 与 Ag⁺, Pb²⁺, Hg₂²⁺
- CO₃²⁻ 与 Ca²⁺, Ba²⁺, Mg²⁺ 等
- 生成气体:
- H⁺ 与 CO₃²⁻, HCO₃⁻, SO₃²⁻, S²⁻ 等
- OH⁻ 与 NH₄⁺
- 生成水或弱电解质:
- H⁺ 与 OH⁻ (生成水)
- H⁺ 与 CH₃COO⁻, CO₃²⁻, S²⁻, ClO⁻ 等 (生成弱酸)
- OH⁻ 与 NH₄⁺ (生成弱碱NH₃·H₂O)
- 发生氧化还原反应:
- Fe³⁺ 与 I⁻, S²⁻, SO₃²⁻
- MnO₄⁻ (H⁺环境下) 与 I⁻, Br⁻, Fe²⁻, SO₃²⁻ 等
- NO₃⁻ (H⁺环境下) 与 I⁻, Fe²⁺, SO₃²⁻ 等
- 发生络合反应:
- Fe³⁺ 与 SCN⁻ (生成血红色[Fe(SCN)]²⁺)
- Ag⁺ 与 NH₃·H₂O (过量)
- 生成沉淀:
- 解题关键
- 看清题目要求(“大量共存”、“不能共存”、“一定量”等)。
- 注意溶液的酸碱性(即H⁺和OH⁻的限制)。
- 注意有色离子(如Fe³⁺为黄色,Fe²⁺为浅绿色,Cu²⁺为蓝色,MnO₄⁻为紫色)。
离子反应的应用
- 物质检验与鉴别
- 利用特征离子反应产生沉淀、气体、颜色变化等现象。
- 举例:
- 用BaCl₂溶液和稀盐酸检验SO₄²⁻。
- 用AgNO₃溶液和稀硝酸检验Cl⁻。
- 用NaOH溶液检验NH₄⁺(产生刺激性气味气体)。
- 物质除杂
- 加入试剂,使杂质离子转化为沉淀或气体而除去。
- 原则:不引入新杂质;不减少主要物质;最好能将杂质离子转化为原料。
- 举例:除去NaCl溶液中的Na₂SO₄,可加入适量BaCl₂溶液。
- 溶液配制
- 配制某些盐溶液时,需考虑离子间的水解反应,抑制水解以保证溶液浓度准确。
- 举例:配制FeCl₃溶液,需加入少量稀盐酸。
- 化工生产
- 沉淀法:从海水中提取Mg(OH)₂,从卤水中提取Br₂。
- 离子交换法:水的软化(去除Ca²⁺, Mg²⁺)。
特殊情境下的离子反应
- “量”不同,产物不同
- 举例:少量CO₂通入澄清石灰水中 vs. 过量CO₂通入澄清石灰水中。
- 少量:CO₂ + Ca²⁺ + 2OH⁻ = CaCO₃↓ + H₂O
- 过量:CO₂ + Ca²⁺ + OH⁻ = Ca(HCO₃)₂
- 举例:少量CO₂通入澄清石灰水中 vs. 过量CO₂通入澄清石灰水中。
- 滴加顺序不同,现象不同
- 举例:向AlCl₃溶液中滴加NaOH溶液 vs. 向NaOH溶液中滴加AlCl₃溶液。
- AlCl₃ → NaOH:先产生白色沉淀,后沉淀溶解。
- NaOH → AlCl₃:先无明显现象,后产生白色沉淀,且不溶解。
- 举例:向AlCl₃溶液中滴加NaOH溶液 vs. 向NaOH溶液中滴加AlCl₃溶液。
- 酸碱中和滴定
- 原理:利用中和反应 H⁺ + OH⁻ = H₂O,通过测定已知浓度的酸(或碱)来测定未知浓度的碱(或酸)。
- 指示剂:在滴定终点附近发生颜色变化(如酚酞由无色变浅红,甲基橙由黄变橙)。