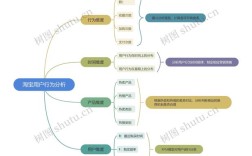
钠 思维导图
中心主题:钠
基础信息
- 元素符号: Na
- 原子序数: 11
- 元素周期表位置:
- 周期: 第3周期
- 族: 第IA族 (碱金属)
- 相对原子质量: 22.99
- 发现: 1807年,英国化学家汉弗里·戴维 通过电解氢氧化钠首次发现。
- 名称来源: 源自拉丁语 natrium,意为“天然碱”。
物理性质
- 颜色: 银白色,有金属光泽。
- 状态: 室温下为固体,质地柔软(可用小刀切割)。
- 密度: 0.97 g/cm³ (小于水,会浮在水面上)。
- 熔点: 97.8 °C (较低,在手上会熔化)。
- 沸点: 883 °C。
- 导电性: 良好的电和热的导体。
- 其他特性: 切口在空气中会迅速失去光泽,变暗。
化学性质 (极其活泼)
- 核心特点: 极易失去最外层的一个电子,形成带+1价电荷的钠离子 (Na⁺),强还原剂。
- 与氧气反应:
- 常温:
4Na + O₂ → 2Na₂O(生成白色氧化钠) - 点燃:
2Na + O₂ --点燃→ Na₂O₂(生成淡黄色过氧化钠)
- 常温:
- 与水反应 (剧烈):
- 现象: 浮在水面、熔成小球、四处游动、发出嘶嘶声、产生气体。
- 化学方程式:
2Na + 2H₂O → 2NaOH + H₂↑ - 离子方程式:
2Na + 2H₂O → 2Na⁺ + 2OH⁻ + H₂↑
- 与氯气反应 (剧烈):
- 现象: 剧烈燃烧,产生大量白烟。
- 化学方程式:
2Na + Cl₂ --点燃→ 2NaCl(生成氯化钠,即食盐)
- 与硫反应 (爆炸):
- 现象:
- 化学方程式:
2Na + S --研磨→ Na₂S(甚至会发生爆炸)
- 与酸反应 (比与水反应更剧烈):
- 化学方程式:
2Na + 2HCl → 2NaCl + H₂↑
- 化学方程式:
- 与某些盐溶液反应 (先与水反应):
- 原理: 钠先与水反应生成NaOH和H₂,生成的NaOH再可能与盐反应。
- (与CuSO₄溶液):
2Na + 2H₂O → 2NaOH + H₂↑2NaOH + CuSO₄ → Cu(OH)₂↓ + Na₂SO₄- 总现象: 钠熔成小球,四处游动,产生气体,溶液中出现蓝色沉淀。
制备方法
- 工业制法 (电解法):
- 原料: 熔融的氯化钠。
- 原理: 电解熔融NaCl,在阴极得到液态钠。
- 化学方程式:
2NaCl(熔融) --电解→ 2Na + Cl₂↑
- 实验室制法 (化学法 - 较少用):
4NaOH + Ti → Ti(OH)₄ + 2Na(利用置换反应,但成本高,不常用)
重要化合物
- 氧化钠 (Na₂O)
- 颜色/状态: 白色固体
- 性质: 碱性氧化物,与水反应生成强碱。
- 化学方程式:
Na₂O + H₂O → 2NaOH
- 过氧化钠 (Na₂O₂)
- 颜色/状态: 淡黄色固体
- 性质: 强氧化剂,与水或二氧化碳反应。
- 与水反应:
2Na₂O₂ + 2H₂O → 4NaOH + O₂↑(产生氧气,可用作供氧剂) - 与CO₂反应:
2Na₂O₂ + 2CO₂ → 2Na₂CO₃ + O₂↑(可用于呼吸面具或潜艇中供氧)
- 氢氧化钠 (NaOH)
- 俗称: 烧碱、火碱、苛性钠
- 性质: 强碱,白色固体,极易潮解,强腐蚀性。
- 用途: 造纸、肥皂、纺织、石油精炼等。
- 氯化钠 (NaCl)
- 俗称: 食盐
- 性质: 中性,离子化合物。
- 用途: 调味品、生理盐水、化工原料 (制NaOH, Cl₂, H₂)。
- 碳酸钠 (Na₂CO₃)
- 俗称: 纯碱、苏打 (注意:不是小苏打)
- 性质: 水溶液呈碱性。
- 用途: 玻璃制造、洗涤剂、造纸。
- 碳酸氢钠 (NaHCO₃)
- 俗称: 小苏打
- 性质: 水溶液呈弱碱性,受热易分解。
- 化学方程式:
2NaHCO₃ --△→ Na₂CO₃ + H₂O + CO₂↑ - 用途: 面粉膨松剂、灭火器、治疗胃酸过多。
主要用途
- 合金:
- 钠钾合金: 常温下呈液态,用作核反应堆的冷却剂。
- 铅钠合金: 用作汽油抗爆剂 (四乙铅的替代品)。
- 还原剂:
- 在工业上用于制备钛、锆、铌等活泼金属。
TiCl₄ + 4Na --高温→ Ti + 4NaCl
- 光源:
高压钠蒸气灯发出的光线穿透力强,常用于道路照明。
- 化工原料:
用于制造过氧化钠、氰化钠等。
- 有机合成:
在某些反应中用作还原剂或催化剂。
安全与储存
- 危险性:
- 遇水爆炸: 与水、酸、醇类等含活泼氢的物质接触会剧烈反应,放出易燃易爆的氢气,可能引起燃烧或爆炸。
- 腐蚀性: 其生成的氢氧化物具有强腐蚀性。
- 燃烧产物: 在空气中燃烧可能生成过氧化物,遇水或有机物也会爆炸。
- 安全操作:
- 严禁用手直接接触。
- 切取时需在煤油中,用镊子夹取,并在玻璃片上用小刀切割。
- 剩余的钠碎屑必须放回原煤油中,不可随意丢弃。
- 储存方法:
- 隔绝空气和水。
- 通常保存在煤油或石蜡油中,使其与空气和水分隔绝。