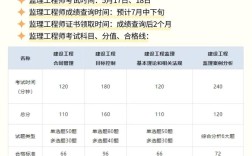
注册设备报名条件通常涉及多个维度的要求,具体需根据设备类型、应用场景(如医疗、工业、环保等)、监管政策及报名目的(如市场准入、资质认证、项目申报等)综合确定,以下从通用性角度梳理核心条件,并辅以不同领域的补充说明,帮助全面理解注册设备需满足的基本门槛。
基本资质要求
所有设备注册均需满足主体资格与设备基础合规性两大核心前提。
-
注册主体资质:
- 企业或组织需具备合法营业执照,经营范围涵盖设备生产、销售或相关技术服务;
- 若为进口设备,需提供国内代理商或进口商资质证明,包括海关进口报关单、商检报告等;
- 部分领域(如医疗器械、特种设备)要求主体具备特定行业许可证,如《医疗器械经营许可证》《特种设备生产许可证》等。
-
设备合法性基础:
- 设备需符合国家强制性标准(GB标准)或行业推荐标准,提供第三方检测机构出具的产品合格检测报告;
- 涉及安全、环保、健康的设备(如压力容器、辐射装置),需通过国家相关部门的安全评估或认证,如中国国家强制性产品认证(CCC认证)、CE认证(出口设备)等。
技术性能与文件要求
注册过程中需提交详细的技术文件,证明设备的设计、性能、安全性及适用性。

-
技术文档清单:
| 文件类型 | 内容要点 |
|------------------|--------------------------------------------------------------------------|
| 产品技术说明书 | 设备原理、结构组成、功能参数、工作条件、操作流程等 |
| 质量管理体系文件 | ISO 9001等质量体系认证证书,生产过程质量控制记录(如原材料检验、工艺参数) |
| 安全性评估报告 | 电气安全、机械安全、电磁兼容(EMC)等测试数据,风险分析与防控措施 |
| 临床/应用验证报告 | 医疗设备需提供临床试验数据(如伦理委员会批准文件、病例报告);工业设备需提供用户试用报告或第三方性能验证报告 |
| 标签与标识文件 | 设备铭牌信息(型号、规格、生产日期、制造商)、警示标识、使用说明书(符合语言规范) | -
性能指标符合性:
设备核心参数(如精度、效率、能耗、寿命等)需满足注册标准要求,- 医疗设备:诊断设备的灵敏度、特异性需符合《医疗器械技术指导原则》;
- 工业设备:节能指标需达到《能效标识管理办法》的能效等级要求;
- 环保设备:污染物去除率需符合国家或地方排放标准(如《大气污染物综合排放标准》)。
行业特定条件
不同行业对设备注册有差异化要求,以下为典型领域补充说明:
-
医疗器械设备:
- 按风险等级分为一类、二类、三类,需对应办理备案或注册(如三类医疗器械需提交国家药监局审批);
- 涉及生物相容性、无菌要求的设备(如植入物、体外诊断试剂),需提供生物学评价报告和灭菌验证数据;
- 首次注册的设备需提供产品创新证明或专利证书。
-
特种设备(如锅炉、电梯、起重机械):
- 需通过特种设备检验机构的安全技术检验,取得《特种设备使用登记证》;
- 制造商需具备《特种设备制造许可证》,安装、改造、维修单位需具备相应资质。
-
进口设备:
- 需提供原产地证明、进口关税缴纳证明、中文版说明书及标签;
- 部分设备需通过中国国家强制性产品认证(CCC认证)或海关验放流程;
- 涉及专利技术的设备,需提供知识产权授权证明。
其他补充条件
-
售后服务保障:
需提供设备维护保养方案、故障响应机制(如24小时服务热线)、备件供应承诺,部分领域(如医疗设备)要求在境内设立技术服务中心或授权维修点。 -
数据与隐私合规:
涉及数据采集、传输的设备(如物联网设备、智能医疗设备),需符合《网络安全法》《数据安全法》要求,提供数据加密、存储及隐私保护方案。 -
环保与节能要求:
设备需符合国家绿色制造标准,提供环评批复文件(如涉及污染物排放)或节能认证证书(如列入《节能产品政府采购清单》的设备)。
相关问答FAQs
Q1:中小企业首次注册工业设备,是否必须提供ISO 9001认证?
A1:并非所有领域强制要求ISO 9001认证,但若设备用于政府采购、重大项目投标或特定行业(如汽车制造、航空航天供应链),通常需提供质量体系认证文件,建议根据目标应用场景提前准备,若无认证,可提供企业内部质量控制流程文件(如原材料检验标准、生产作业指导书)作为补充。
Q2:进口医疗设备注册时,临床试验数据是否必须在中国本地开展?
A2:不一定,若设备已在欧盟、美国等成熟市场上市,可提供原产国的临床试验数据(如CE认证文件、FDA批准文件),但需提交中国境内临床试验机构的数据桥接报告或伦理审查豁免申请;对于高风险或创新型医疗设备,通常要求在中国境内开展临床试验,以验证其在亚洲人群中的有效性和安全性。