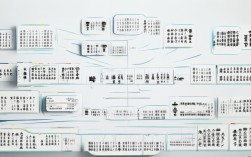
氧气 思维导图
中心主题:氧气 (O₂)
基本性质
-
物理性质
- 状态: 通常情况下是无色、无味的气体。
- 溶解性: 难溶于水 (1L水约溶解30mL氧气),这是水中生物生存的基础。
- 密度: 密度比空气略大 (标准状况下: 1.429g/L)。
- 三态变化:
- 液化: 降温、加压可变为淡蓝色液体。
- 凝固: 继续降温可变为淡蓝色雪花状固体。
-
化学性质
- 核心特性: 化学性质非常活泼,是强氧化剂,具有助燃性。
- 与非金属反应:
- 碳: C + O₂ ---(点燃)--> CO₂ (发出白光,放热)
- 硫: S + O₂ ---(点燃)--> SO₂ (明蓝紫色火焰,有刺激性气味)
- 磷: 4P + 5O₂ ---(点燃)--> 2P₂O₅ (产生大量白烟)
- 氢气: 2H₂ + O₂ ---(点燃)--> 2H₂O (安静燃烧,产生淡蓝色火焰)
- 与金属反应:
- 镁: 2Mg + O₂ ---(点燃)--> 2MgO (发出耀眼白光,生成白色固体)
- 铁: 3Fe + 2O₂ ---(点燃)--> Fe₃O₄ (火星四射,生成黑色固体)
- 铜: 2Cu + O₂ ---(加热)--> 2CuO (黑色固体)
- 与化合物反应:
- 甲烷: CH₄ + 2O₂ ---(点燃)--> CO₂ + 2H₂O (蓝色火焰)
- 乙醇: C₂H₅OH + 3O₂ ---(点燃)--> 2CO₂ + 3H₂O
- 一氧化碳: 2CO + O₂ ---(点燃)--> 2CO₂
制取方法
-
实验室制法
- 药品: 过氧化氢溶液 (H₂O₂)、高锰酸钾 (KMnO₄)、氯酸钾 (KClO₃) 与二氧化锰 (MnO₂)。
- 反应原理:
- 过氧化氢法: 2H₂O₂ ---(MnO₂催化)--> 2H₂O + O₂↑ (反应条件温和,易于控制)
- 高锰酸钾法: 2KMnO₄ ---(加热)--> K₂MnO₄ + MnO₂ + O₂↑ (装置简单,不需催化剂)
- 发生装置: 固体与液体不加热型 / 固体加热型。
- 收集方法:
- 排水法: 因为氧气不易溶于水。
- 向上排空气法: 因为氧气密度比空气大。
- 检验方法: 将带火星的木条伸入集气瓶中,若木条复燃,则是氧气。
- 验满方法:
- 排水法: 当集气瓶口有大气泡冒出时,已收集满。
- 向上排空气法: 将带火星的木条放在集气瓶口,若木条复燃,已收集满。
-
工业制法
- 方法: 分离液态空气。
- 原理: 利用液态氮 (沸点约-196°C) 和液态氧 (沸点约-183°C) 的沸点不同,通过蒸发、冷凝,将它们分离开。
- 过程: 空气 → 降温加压液化 → 蒸发 (氮气先逸出) → 液态氧。
主要用途
-
供给呼吸
- 医疗: 用于急救、缺氧病人的治疗 (如高压氧舱)。
- 潜水: 潜水员和潜水艇乘员的生命支持系统。
- 高空/登山: 为飞行员、登山者提供氧气。
-
支持燃烧
- 工业: 炼钢、气焊、气割 (利用乙炔、氧气火焰的高温)。
- 航天: 火箭助燃剂。
- 生活: 用作富氧空气,提高燃烧效率,减少污染物排放。
-
化工生产
- 合成氨: 制造氮肥。
- 制硫酸: 硫酸工业中的关键氧化步骤。
- 合成塑料、药物: 作为重要的氧化剂和原料。
发现与历史
- 发现者:
- 卡尔·威廉·舍勒 (瑞典): 约在1773年,通过加热某些物质 (如硝酸钾、HgO) 发现了“火空气”,即氧气。
- 约瑟夫·普里斯特里 (英国): 1774年,用透镜聚焦阳光加热氧化汞,首先收集到了氧气,称之为“脱燃素气”。
- 命名者:
- 安托万-洛朗·拉瓦锡 (法国): 被誉为“近代化学之父”,他通过实验证明了氧气在燃烧中的作用,推翻了“燃素说”,并正式将其命名为 "Oxygen" (意为“酸的生成者”,因为他当时认为所有酸都含有氧)。
存在与循环
-
存在形式
- 游离态: 占大气体积的约 21% (按体积计算)。
- 化合态: 是地壳中含量最高的元素,以氧化物、硅酸盐等形式广泛存在于水、岩石、矿物中 (如 SiO₂, H₂O, CaCO₃)。
-
循环 (自然界中的重要循环)
- 光合作用: 绿色植物、藻类和某些细菌利用光能,将二氧化碳和水转化为葡萄糖和氧气。
- 6CO₂ + 6H₂O ---(光/叶绿体)--> C₆H₁₂O₆ + 6O₂
- 呼吸作用: 动物、植物和微生物吸入氧气,将体内的有机物分解,释放能量,并产生二氧化碳和水。
- C₆H₁₂O₆ + 6O₂ ---(酶)--> 6CO₂ + 6H₂O + 能量
- 动态平衡: 光合作用和呼吸作用共同维持了大气中氧气和二氧化碳含量的相对稳定,为地球生命提供了保障。
- 光合作用: 绿色植物、藻类和某些细菌利用光能,将二氧化碳和水转化为葡萄糖和氧气。
重要性与影响
- 生命的基础: 没有氧气,绝大多数需氧生物无法生存。
- 能量代谢的关键: 是细胞有氧呼吸的最终电子受体,是获取高效能量的必要条件。
- 维持生态平衡: 在碳、氮等元素循环中扮演核心角色。
- 双刃剑效应:
- 益处: 生命活动、工业生产、医疗救治的必需品。
- 害处: 氧气过于活泼,会参与生物体的氧化反应,导致细胞衰老和损伤 (自由基理论);高浓度氧气易燃,有安全隐患。