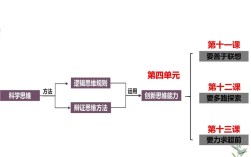
,主要涉及溶液的形成、特征、组成、分类及相关计算等核心知识点,通过思维导图的形式梳理,可以帮助学生建立清晰的知识框架,理解溶液的本质和规律,以下从溶液的基本概念、组成表示方法、溶解度、相关计算及实际应用等方面展开详细阐述。
溶液是由一种或一种以上的物质分散到另一种物质中,形成的均一、稳定的混合物,被溶解的物质称为溶质,能溶解其他物质的物质称为溶剂,水是最常见的溶剂,但汽油、酒精等也可作为溶剂,溶液的基本特征是均一性和稳定性,均一性指溶液中各部分的浓度、性质相同;稳定性指在外界条件(如温度、压强)不改变时,溶质和溶剂不会分离,溶液按溶质状态可分为固体溶液(如合金)、液体溶液(如食盐水)和气体溶液(如空气);按溶剂状态可分为水溶液和非水溶液。
溶液的组成表示方法有多种,其中溶质的质量分数是初中化学的重点,计算公式为溶质质量分数=(溶质质量/溶液质量)×100%,物质的量浓度是高中化学的重要概念,定义为单位体积溶液中所含溶质的物质的量,单位为mol/L,计算公式为c=n/V,其中n为溶质的物质的量,V为溶液的体积,对于一定温度下的饱和溶液,还可利用溶解度与溶质质量分数进行换算,关系式为溶质质量分数=(溶解度/(100g+溶解度))×100%。
溶解度是描述物质溶解能力的重要物理量,指在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,单位为克(g),影响固体溶解度的因素主要是温度:大多数固体物质的溶解度随温度升高而增大(如硝酸钾),少数物质溶解度受温度影响较小(如氯化钠),极少数物质溶解度随温度升高而减小(如熟石灰),气体的溶解度则随温度升高而减小,随压强增大而增大,因此气体溶解度常指该气体在压强为101kPa和一定温度时溶解在1体积水中达到饱和状态时的气体体积数,溶解度曲线是表示物质溶解度随温度变化的曲线,通过曲线可查出某物质在一定温度下的溶解度,比较不同物质溶解度的大小,以及判断溶解度随温度变化的趋势。
溶液的相关计算是本单元的重点和难点,主要包括以下几种类型:一是溶质质量分数的计算,涉及溶液的稀释、浓缩、配制等过程,稀释前后溶质质量不变,公式为m₁×w₁=m₂×w₂;二是溶解度与溶质质量分数的换算,需明确饱和溶液中溶质、溶剂、溶液的质量关系;三是溶液中溶质的质量与物质的量的换算,需利用摩尔质量(M)和物质的量浓度(c)进行转换,关系式为m=n×M=n×c×V;四是涉及化学反应的溶液计算,需结合化学方程式,找出溶质与生成物或反应物之间的质量关系,进行综合计算,将一定质量的氯化钠溶液与硝酸银溶液反应,根据生成的氯化银沉淀质量可计算原氯化钠溶液中溶质的质量分数。
溶液在生活和生产中有广泛的应用,医疗上,生理盐水(0.9%的氯化钠溶液)用于补充体液和电解质;农业上,根据作物需求配制一定溶质质量分数的农药溶液;工业上,利用溶液的性质进行金属表面处理(如除锈)、溶液的蒸发结晶(如从海水中提取食盐)等,溶液的酸碱性也是重要应用,pH<7的溶液为酸性,pH=7为中性,pH>7为碱性,常用pH试纸或pH计测定溶液的酸碱性,酸碱中和反应在医药(如治疗胃酸过多)、化工生产中具有重要意义。
为了更直观地理解溶液的相关概念,以下列出溶液分类及常见实例的表格:
| 分类依据 | 溶液类型 | 实例 |
|---|---|---|
| 溶质状态 | 固体溶液 | 黄铜(铜锌合金) |
| 液体溶液 | 医用酒精(乙醇水溶液) | |
| 气体溶液 | 汽水(二氧化碳水溶液) | |
| 溶剂状态 | 水溶液 | 蔗糖水 |
| 非水溶液 | 碘酒(碘酒精溶液) | |
| 溶液饱和程度 | 饱和溶液 | 一定温度下不能再溶解硝酸钾的溶液 |
| 不饱和溶液 | 一定温度下还能继续溶解溶质的溶液 |
在溶液的学习中,学生常对以下问题存在疑惑,以下是两个常见问题的解答:
问题1:饱和溶液与浓溶液、不饱和溶液与稀溶液是否等同?
解答:不等同,饱和溶液与不饱和溶液是按溶液是否达到饱和状态划分的,而浓溶液与稀溶液是按溶质质量分数大小划分的,熟石灰在20℃时的溶解度约为0.17g,其饱和溶液的溶质质量分数很小,属于稀溶液;而硝酸钾在20℃时的溶解度约为31.6g,其不饱和溶液的溶质质量分数可能较大,属于浓溶液,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,两者是从不同角度对溶液的分类。
问题2:为什么有些物质溶于水时溶液温度升高,有些则降低?
解答:物质溶于水时伴随热量的变化,主要取决于溶质扩散过程和水合过程的热量差异,扩散过程是溶质分子(或离子)克服分子间作用力分散到水中的过程,需要吸收热量,为吸热过程;水合过程是溶质分子(或离子)与水分子结合形成水合分子(或水合离子)的过程,会放出热量,为放热过程,若水合过程放出的热量大于扩散过程吸收的热量,溶液温度升高(如氢氧化钠、浓硫酸溶于水);若扩散过程吸收的热量大于水合过程放出的热量,溶液温度降低(如硝酸铵、氯化铵溶于水),若两者热量相差不大,溶液温度基本不变(如氯化钠溶于水)。